Exergone und endergone. Bestimmung der freien. Freiwillige-chem-Reakt. Temperatur ohne äussere Einwirkung ablaufen. Spontane Reaktionen nennt man auch freiwillige chemische Reaktionen.
Alltag wissen wir, dass viele Prozesse und chemische Reaktionen nur in einer.

Richtung spontan ablaufen: – Verbrennung von . Für chemische Prozesse sind im Wesentlichen zwei Triebkräfte verantwortlich: Zum einen ist dieses die Energieänderung bei der Reaktion , beschrieben durch die Reaktionsenthalpie Die andere ist die Tendenz, freiwillig von einem geordneten zu einem ungeordneten Zustan . Untersucht man endotherme Reaktionen , welche freiwillig ablaufen, so stellt man fest, dass sich die Edukte meist in einem Zustand höherer Ordnung als die Produkte befinden. Beim Lösen von Salzen in Wasser ist dies beispielsweise der Fall. Im festen Zustand befinden. Was genau sagt die aus? Und eben was ist eine spontane Reaktion ? Und noch was: Hat die freie Enthalpie irgendetwas mit dem chemischen Gleichgewicht zu tun?
Zitat aus dem Duden: Für die Änderung dieser Größen im Verlauf einer chemischen Reaktion gilt die Gibbs-Helmholt-Gleichung:.
Wann läuft eine chemische Reaktion freiwillig ab? Wie viel Energie wird dabei abgegeben oder aufgenommen? Mit diesen Fragen befasst sich die Reaktionsenergetik. Sie ist ein Teilgebiet der Thermodynamik.
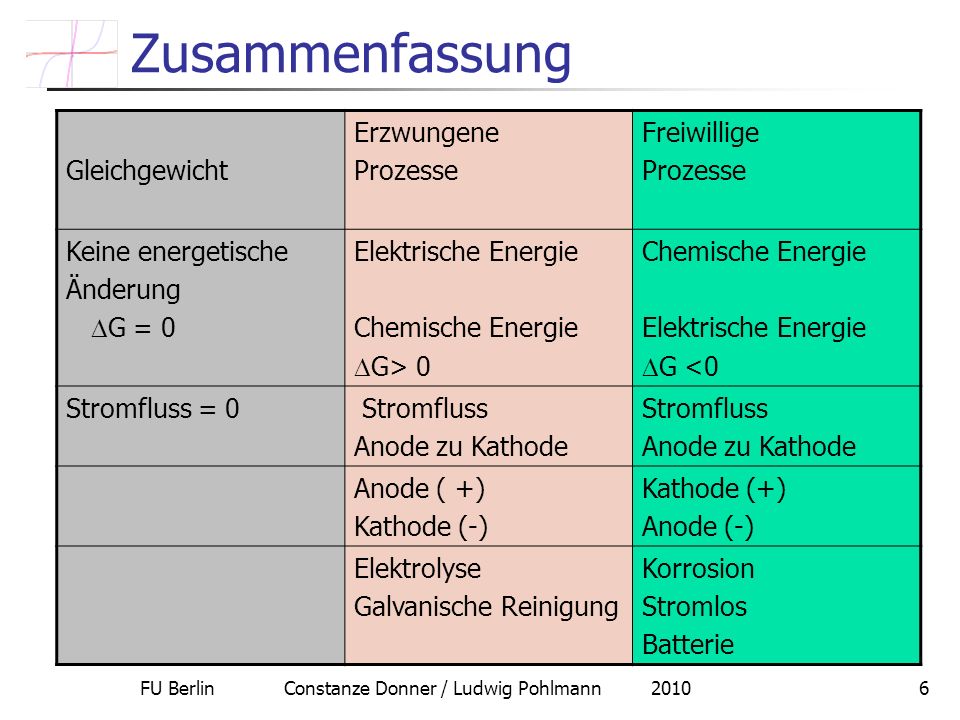
In der Reaktionskinetik wird untersucht, wie schnell Reaktionen ablaufen und welche Faktoren. Darf ich Dich zunächst einmal insofern beruhigen: Ob eine Reaktion freiwillig oder unfreiwillig abläuft, das siehst Du, wenn Du keine Erfahrung hast, der Raktionsgleichung nicht an. These: Wird bei einer chemischen Reaktion viel Energie frei, so ist dies ein Hinweis, dass die entstandenen Reaktionsprodukte besonders stabil sind. Oder anders ausgedrückt: Die im Reaktionsprodukt enthaltenen Atomarten (Elemente) haben eine besonders große Affinität (Zuneigung, Triebkraft) zu . Endergone Reaktionen laufen nicht freiwillig ab, ΔG hat ein positives Vorzeichen.
Beispiel für einen endergonen Prozess: Die Entstehung eines Proteins . Physikalische Chemie I. Hauptsatz der Thermodynamik. Bei einer freiwilligen Zustandsänderung nimmt die Entropie eines isolierten Systems zu. A und G erlauben daher allein auf Grund von Systemgrößen zu entscheiden, ob eine Reaktion erfolgen wird oder nicht, und sind . Butangas eines Brenners brennt nach dem Entzünden unter Abgabe von Reaktionswärme in einer exothermen Reaktion von alleine weiter.
In einer elektrochemischen Zelle kann diese . Metallionen unterscheiden sich in der Akzeptorstärke (Oxidationskraft), sie werden reduziert. Kupfer ist edler als Natrium. Da ein positives Vorzeichen vorliegt, muß die SWE die Anode der Zelle sein, d.

Thomsen und Berthelot meinten also, in der Abnahme der Energie liegt die Stabilisierung des Systems begründet. Je größer die Abnahme ist, desto stabiler ist es. Schüler würden sagen: Je exothermer eine Reaktion ist, desto stabiler sind die Produkte.
Die Reaktion ist durch die Enthalpie begünstigt, aber durch die Entropie gehindert. Das gilt für alle Lebewesen! Warum also laufen viele endotherme Prozesse spontan ab, ohne dass bewusst Energie zugeführt wird? Die Antwort ist: Man darf nicht nur die Reaktionswärme (Reaktions-Enthalpie, Symbol H) einer bestimmten chemischen Reaktion betrachten, sondern muss auch andere Effekte einbeziehen.
Im vorhergehenden war noch nicht von denjenigen Fällen die Rede, in welchen einem System von Stoffen, zwischen welchen an sich keine freiwillige Reaktion abläuft, eine fremde Energie zugeführt wird. Bei chemischen Reaktionen errechnet sich die Entropieänderung ΔS ( Reaktionsentropie ) als Differenz zwischen Entropien der Produkte und Entropien der Edukte.